最近の研究
ガラス・ジャミングのレオロジー
〜マヨネーズとガラスの物理的共通性を解明〜 東京大学池田昌司研との共同研究
マヨネーズやシェービングフォームのような「ソフトジャム固体」に見られる特異な粘性の性質が、ガラスやアモルファス固体に見られる特有の振動モード(準局在振動:ボゾンピーク)と深く関係していることを明らかにしました。
ソフトジャム固体とは、柔らかい粒子がランダムに詰まってできた物質で、液体と固体の中間のような性質を示します。産業製品にもよく使われ、日常生活の中にも数多く存在しながら、その力学的性質の本質はこれまで十分に理解されてきませんでした。中でも、外部からゆっくり力を加えた際に現れる「異常に大きな粘性損失」という現象は、従来の粘弾性理論では説明が難しく、長らく未解明の課題とされてきました。 この問題に取り組むために私たちは、マイクロレオロジーにより高密度エマルジョンの粘弾性測定を行いました。光学的な方法を用いて試料に埋め込んだ微粒子の熱揺らぎを高い時空間分解能で精密に計測しました。この実験により、ソフトジャム固体が持つ異常な粘弾性応答を、これまでにない高精度で定量的に捉えることができました(図1参照)。特に注目すべきは、粘性損失が周波数の0.5乗(∝ ω¹ᐟ²)に比例して増加するという明確なスケーリング則が観測された点です。このような非標準的な周波数依存性は、通常の粘弾性体では現れず、構造が乱れた材料に特有の動力学的応答であると考えられます。
得られたデータを詳細に理論解析した結果、この現象の起源が、粒子間のランダムな接触ネットワークに存在する散逸をともなう振動モード(ボゾンピーク)にあることが分かりました。
ガラスでは、ランダムな接触ネットワークを介して伝播する振動の中に、準局在的かつ非弾性的な振動成分が存在し、それがエネルギー散逸を生み出します。外部からの周期的な力に対し、これらのモードが応答することで、エネルギーが蓄積されず散逸される。ソフトジャム固体では、このガラスの異常な振動モードに対応する異常な緩和モードが現れ(図2)、それが実験で観測されたω¹ᐟ²スケーリングを理論的に完全に再現します(図1)。
このような関係を視覚的に示したのが本研究の概念図(図2)です。ソフトジャム固体内部の構造の乱雑性と、それに起因する異常な緩和モードが、外力に応じてエネルギーをどのように散逸させるか?は興味深くも難解な問題です。今回、ガラスとソフトジャム固体の関係性が明らかになったことで、マクロな力の印加とミクロな構造揺らぎの間にある、散逸の橋渡しとなるメカニズムを直感的に理解することができるようになりました。
本研究は、「柔らかく詰まった系」のようなソフトマターと、「構造が乱れたガラス」のようなアモルファス物質が、統一的な物性物理の枠組みで記述できることを示した初の成果の一つです。これにより、今後の非平衡物質の物理的理解や、次世代材料の設計にも新たな指針を与えると期待されます。
本研究成果は、Nature Physics誌に掲載されました。 DOI: 10.1038/s41567-024-02722-7
細胞の非平衡レオロジー
生きた細胞内部の非平衡レオロジーを直接測定する方法を開発
これまで技術的に困難とされていた「生きた細胞の内部」のレオロジー的性質、つまり硬さ・ねばり・細胞が生み出す力の大きさを測定することに成功しました。
レオロジーとは、物質の流れや変形のしやすさを示す物性であり、工業製品やハイテク機器の性能・耐久性を評価する際にも重要な指標です。私たちの身体を構成する最小単位である「細胞」の機能や状態を正しく理解するためにも、同じようにレオロジーを計測することが強く望まれてきました。しかし、細胞は直径がわずか10マイクロメートルほどしかなく、しかも内部では分子サイズのモーターによる活発な動きが絶えず起きています。このような小さくて絶えず動いている環境の中で、物性を精密に測るのは極めて難しいというのが現実でした。これまでは細胞の外側を引っかくようにして、膜付近の性質を測るしかなく、本当の意味で“内部”の様子を知ることはできなかったのです。
そこで私たちは、生きた細胞の中に微小な粒子を注入し、その粒子の揺らぎや外部からの力に対する応答を高精度で測定する方法を開発しました。細胞内部では細胞質流動と呼ばれる激しい動きが起きていますが、私たちはフィードバック制御を用いてその動きをリアルタイムで補正し、粒子の位置を常にナノメートル以下の精度で捉えることに成功しました(参考図1参照)。
なお、生きた細胞内では粒子が細胞によって動かされているため、粒子の揺らぎが大きいからといって細胞が柔らかい、あるいはサラサラしているとは限りません(これは死んだ細胞の場合に限って言えることです)。そこで私たちは、レーザーで粒子に力を加えたときの応答から、細胞内部のレオロジー特性を正確に引き出す方法を取りました。 さらに、粒子の揺らぎと応答の両方を同時に測ることで、細胞が内部でどのくらいの力を生み出しているのか、どれくらい“元気”なのかを、「揺動散逸定理の破れ」として定量的に評価することも可能になりました(参考図2参照)。
このようにして私たちが開発した測定技術は、生きた細胞内部の物性を初めて直接評価できる手法であり、物理学・細胞生物学・医学といった幅広い分野に大きく貢献することが期待されています。詳しくは解説記事や原著論文を参考にしてください。
アクティブガラスとしての細胞質
混み合いと“かき混ぜ”が生きた細胞のしなやかさを生む
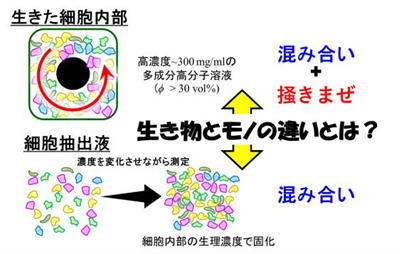
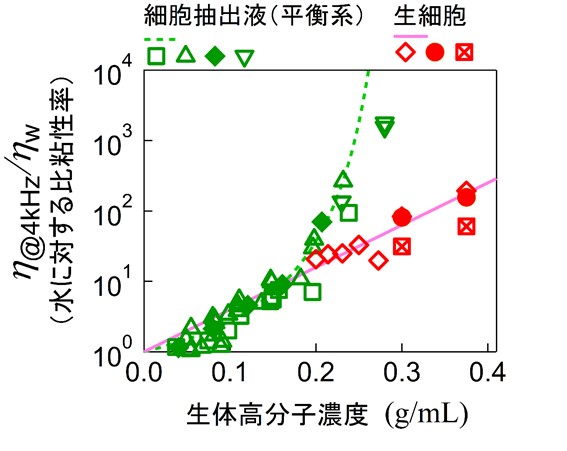
「生きた細胞」と、その中身を取り出した「細胞抽出液」の粘弾性(硬さや粘っこさ)を比較し、両者の違いがどこから来るのかを調べました。その結果、細胞内部にある“混み合った状態”を、モータータンパク質が“かき混ぜる”働きが決定的な役割を果たしていることが明らかになりました(参考図3)。
細胞は、自らの力学的性質(硬さや粘性)を必要に応じて変化させ、多様な機能を発揮します。例えばガラスやゲルといった単なる「モノ」の性質を変えるには、構造そのものを作り変える必要がありますが、細胞のような「生き物」はもっと柔軟かつダイナミックに性質を変えることができます。
この細胞の“しなやかさ”を生み出しているのが、内部の混み合いと、それをモータータンパク質がかき混ぜる活動です。これらが物質の流動性や粘性を大きく左右するのであれば、細胞は単なる物質とは異なる、「生き物らしい」性質を持つと言えるかもしれません。
混み合いとかき混ぜがないと細胞は固まる
私たちはまず、細胞膜を壊して中身だけを取り出した細胞抽出液を用いて、モータータンパク質によるかき混ぜを除いた状態で、内容物の濃度を変えながら力学的性質を測定しました。 すると、濃度が少し高くなるだけで粘性が急激に増加し、抽出液全体が固まってしまうことが分かりました。しかもこの現象は、ヒト細胞・バクテリア・卵細胞・組織細胞など、細胞の種類に関係なく起こり、実際の細胞内濃度(約300mg/mL)よりも低い濃度ですでに固化が始まることが確認されました。 この結果は、細胞がかき混ぜを止めると簡単に固まってしまうことを示唆しています。固まってしまえば、細胞内での物質合成や輸送ができなくなり、生きた細胞としての機能が失われてしまいます。
生きた細胞はなぜ固まらないのか?
そこで、同じように内容物の濃度を変えながら生きた細胞内部の粘弾性も測定してみました。すると、内容物が同じにもかかわらず、生きた細胞は流動性を維持していることが分かりました。粘性の変化のしかたも、抽出液とは全く異なるものでした。 詳細な解析の結果、こうした違いは細胞が自ら内部を“かき混ぜている”ことに由来していると結論づけられました。つまり、細胞は内部の混み合いによる固化を、モータータンパク質の活動で防いでいるのです。
これまで、細胞内部の「混み合い」や「かき混ぜ」は、細胞の力学や機能を考えるうえであまり注目されてきませんでした。しかし実際には、それらが細胞の柔軟性や応答性、さらには健康状態にも深く関わっている可能性があります。 細胞や組織の力学的性質は、がんの悪性化、発生、生殖、幹細胞の分化など、さまざまな生理・病理現象に影響を与えます。今回の成果は、そうした生命現象の理解を深める上での重要な一歩であり、将来的には幅広い分野への応用が期待されます。詳しくは原著論文を参考にしてください。
非ガウス揺らぎのダイナミクス 〜非平衡系に特有の統計性を捉える新たな理論の構築〜
背景:非平衡系に現れる「非ガウス揺らぎ」
平衡状態にある物理系では、物理量の揺らぎは中心極限定理によりガウス分布(正規分布)に従うとされています。特に、均質な連続体として近似できる平衡系のメソスケール(ミクロとマクロの中間スケール)では、観測される量の分布もガウスになるはずです。
しかし現実の非平衡系では、しばしばその期待は裏切られ、明らかに非ガウス的な揺らぎが観測されます。たとえば、 乱流 ガラス・ジャミング系、細胞内の力生成・分子輸送、遊走微生物懸濁液(アクティブマター)などがその代表例です(参考文献1, 参考文献2)。 これらの非ガウスな分布の起源を明らかにすることで、分布の形状やその時間発展を通じて、非平衡系の物理的性質や振る舞いの理解が深まると期待されます。
新しい非ガウス極限分布の構築
従来の統計力学では、分散が有限な相互作用が多数重なった場合、中心極限定理により分布はガウス型になります。一方で、分散が発散するような裾野の広い相互作用が支配的な場合には、レビ分布(Lévy分布)と呼ばれる非ガウスな安定分布に収束することが知られています。
このような統計的極限は、自然界におけるごく一般的な相互作用のように、べき乗的に減衰する相互作用を持つ自然現象に当てはまります。宇宙空間中の恒星間の重力、プラズマ中の静電気力、遊走微生物間の流体力学的相互作用はいずれも距離の2乗に逆比例していることを思い出してください。質点や電荷、遊走微生物(以下”作用源”と呼ぶ)に無限に近い場所では相互作用が発散するために、個別の作用源との相互作用を空間内のある”点”で計測すると、その分散は発散してしまいます。他方で現実には点で相互作用を計測することは出来ないので、個別の作用源との相互作用の分散は収束します。それでは作用源が3次元空間中にランダムに無数に存在しているときはどうでしょうか?無数の作用源との相互作用が重なった結果、前者が良い近似のときはレビ分布、後者が良い近似のときはガウス分布が観測されるはずです。観測量がガウス分布に従うことを仮定するのは、平衡系では後者が良い近似であるからです。他方で非平衡系ではガウスでもレビでもない統計分布がしばしば観測されます。
私たちは、三次元空間中にランダムに分布する相互作用源(例:運動する微生物)によって、空間内に生じる相互作用の揺らぎの極限分布を与える以下のような新しい解析的表現を導出しました(原著論文)。

この分布の特性関数(フーリエ変換)は、以下のパラメータで特徴づけられます: 系の代表的なサイズ(R)、 相互作用源の濃度(c)、 相互作用の強さ(γ)。 この表現は、ガウス分布とレビ分布の両者を連続的につなぐ新たな分布族であり、ここでは3次元の表式しか与えてませんが、空間次元によってその性質が変化する点も特徴的です。
現実の非平衡揺らぎとの接続と展望
この新しい非ガウス分布は、1) 遊走微生物懸濁液(アクティブマター) 2)アクチン-ミオシン系のゲル 3)ガラス状態のソフトマター 4)乱流やジャミング現象のような実際の非平衡系における揺らぎを定量的に説明できる可能性を持っています。私たちは現在、実験、理論解析、数値シミュレーションを組み合わせて、この分布が実際の系で観測される揺らぎを再現できることを検証しています。1)については既に実験による検証を終えて原著論文に発表しています。さらにこの理論枠組みは、相互作用源そのもの(例:微生物や分子モーター)の時間的な動的変化をも取り込むことが可能であると考えており、より現実的な非平衡ダイナミクスの理解へとつながるものと期待しています。
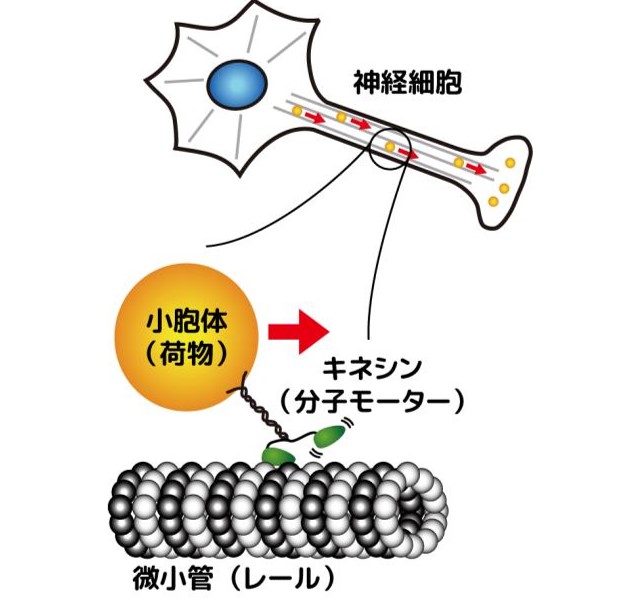
生体分子機械の揺らぎとエネルギー量論 山口大学有賀隆行博士との共同研究
高速フィードバック制御を組み込んだ 光ピンセット装置を使って、 歩行型の生体分子モーター「キネシン」の1分子レベルのエネルギーの入出力を実験的に明らかにしました。数理
モデルと理論計算を通じて、キネシンに入力された化学エネルギーの大半が、荷物を運ぶエネルギーとしては使われずに、分子の内部から熱として散逸していくことがわかりました。詳しくは、解説記事や原著論文を参考にしてください。
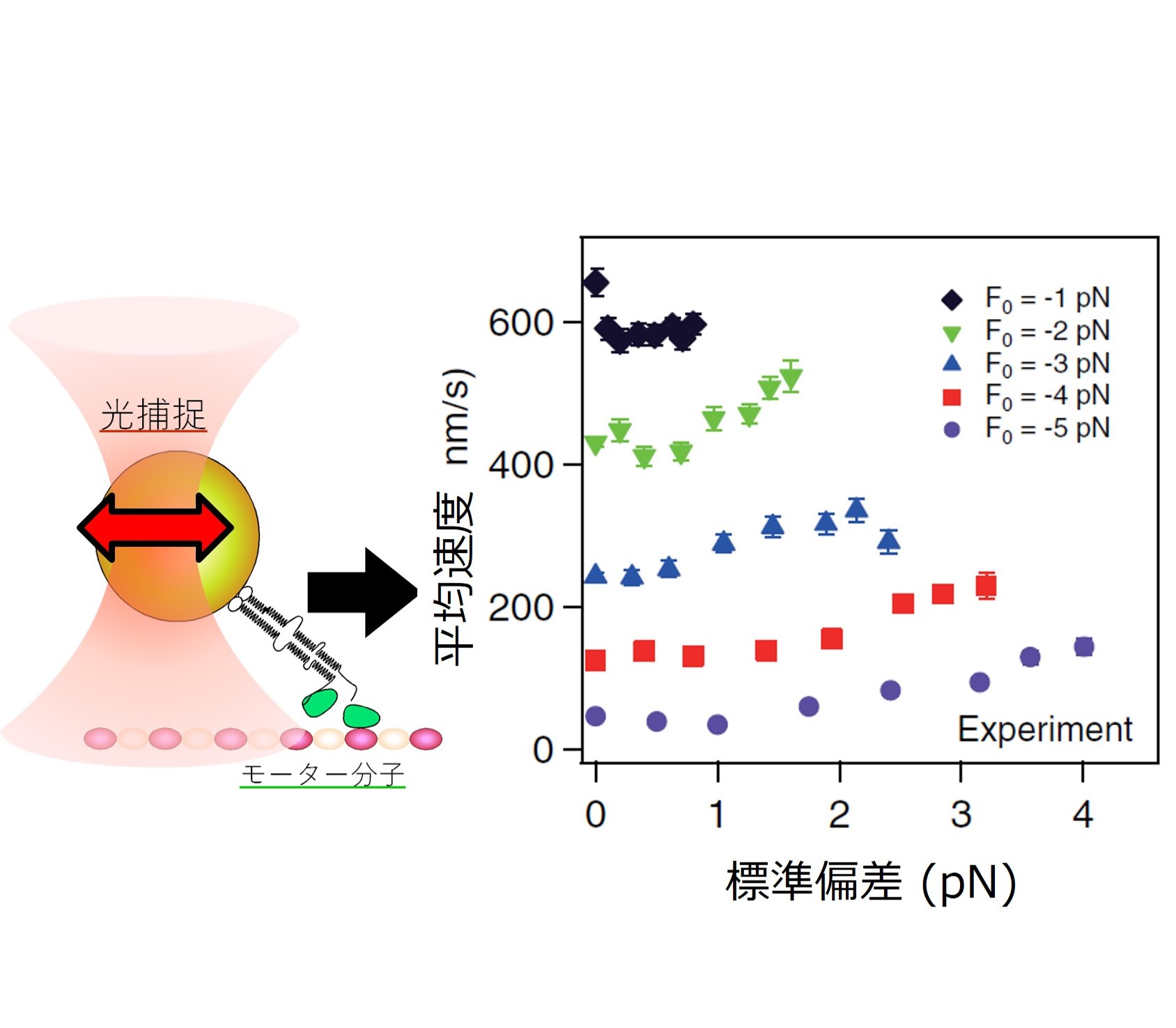
生体分子 分子モーターのキネシンが、細胞内環境を模倣した人工的にゆらぐ力を加えることによって加速する現象を発見しました。特に負荷が高いときに早く
なる 傾向から、細胞内のような混雑して粘性の高い環境に適応している可能性があります。 細つまり、胞内でみられる非熱的なゆらぎは単なるノイズではなく、さまざまな生理的機能を促進するために積極的に利用されているのかもしれません(原著論文)。
交換チャンバーを用いた非平衡力学研究
〜代謝活動が細胞内部の力学環境に与える影響を探る〜
生きた細胞の内部では、ATPなどを消費しながら活動する生体分子のダイナミクスによって、その力学的な環境が形成されていると考えられています。近年の研究により、細胞内部は高濃度な分子が混み合うガラス的な固化状態にあるにもかかわらず、代謝活動の存在によって流動性を維持していることが明らかになりつつあります。 ここで重要な問いとして、 代謝活動は、細胞内部の動的環境にどのように影響を与えているのか? 細胞の流動性を支える“分子的な実体”とは何か?
が挙げられます。 しかし、生きた細胞をそのまま用いてこれらの問いに答えるのは簡単ではありません。なぜなら、細胞は恒常性維持のためのフィードバック応答を持っており、外部から代謝や力学環境を操作しようとすると、細胞側が反応してしまうからです。このため、メカニズムの本質的な理解が困難となります。
細胞抽出液と交換チャンバーを用いた新たなアプローチ
この問題を回避するため、私たちは以下のような新しい実験系を構築しています。
・細胞の中身だけを取り出した「細胞抽出液」を使い、外部から代謝活性を人工的に導入。
・抽出液の中で分子濃度や代謝活性を自在に制御することが可能。
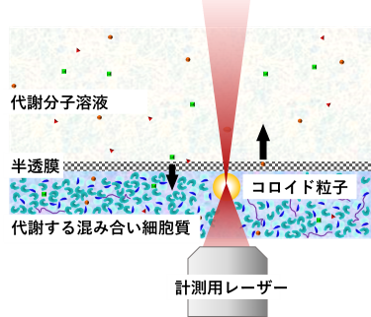
ただし、一般的な密閉系では、生理活性物質の供給や代謝生成物の除去ができないため、長時間のマイクロレオロジー測定中に代謝活動が停止してしまうという問題があります。 そこで私たちは、以下の機能を備えた交換チャンバーを開発しました。
・半透膜を介して、外部から生理活性物質(ATP など)を供給
・同時に、代謝によって生じた老廃物を外に排出
この装置を用いることで、長時間にわたって代謝活動を持続させた状態でのマイクロレオロジー測定が可能となりました(Figure 1)。この系を使うことで、代謝活動が細胞内部の力学環境に及ぼす直接的な効果を、フィードバックの影響を受けずに調べることができます。
このように、交換チャンバーを用いた実験系の構築により、従来は困難だった代謝駆動の非平衡系における力学測定が現実的なものとなりつつあります。細胞や生体分子がどのように非平衡ダイナミクスを生み出し、それが物性にどのような影響を与えるのかを定量的に探るための、有力なアプローチとなっています。
モデル系としての大腸菌懸濁液
細胞内部のような非平衡環境を模倣するモデル系として、私たちは高濃度の大腸菌懸濁液を用いた実験も行っています。
大腸菌は、鞭毛を回転させて自ら運動(遊走)する性質を持っています。この運動の駆動源は、分子モーターであるモータータンパク質ですが、これは顕微鏡では直接観察できません。そこで、大腸菌自身を「動きの見えるモーター」として活用することで、細胞内部の見えない分子によるかき混ぜ効果を、目に見える形で再現・可視化することができます。 さらに、大腸菌の濃度を高めると、個々の運動が相互に影響し合って、集団として渦を巻くような流れが出現します。これは「生体乱流(bacterial turbulence)」と呼ばれ、自己推進する粒子の集団運動として知られています。このような運動系は、アクティブマター(active
matter)と総称され、外部からのエネルギー供給を受けて自律的に運動する非平衡系の代表例として、近年物理学・生物学の両分野で盛んに研究されています。
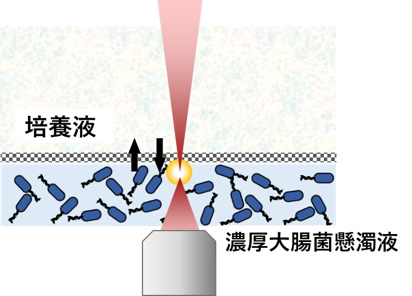
長時間・3次元のアクティブマター観察を可能にする交換チャンバー
アクティブマターの多くは、2次元培養系など比較的薄い環境で観察されてきました。これにより遊走状態は観察可能であるものの、エネルギー源(栄養)が枯渇するとすぐに運動が止まってしまうため、長時間にわたる観測が困難でした。力学計測には3次元系が必要ですが、3次元系のアクティブマターはこれまで実現することが困難でした。 私たちはこの問題を解決するために、交換チャンバーを用いた3次元系を構築しました。 培地(栄養分)を継続的に供給し、代謝によって生じた老廃物を半透膜を通じて排出する構成により、大腸菌の長時間にわたる自律運動を安定して維持できるようになりました。3次元系では、大腸菌がz軸方向にも自由に運動するため、観察はやや難しくなりますが、確かに生体乱流状態が実現されていることを確認しています(Figure 2)。
Movie1: 長時間持続するバクテリア乱流
Movie2: バクテリア乱流(Movie1)の速度場
アクティブガラス状態への遷移
大腸菌の濃度をさらに高めると、集団としての運動(遊走・乱流)が次第に消失し、大腸菌同士の配置換えも抑制された状態になります。この状態は、「アクティブガラス」と呼ばれる擬静止状態であり、大腸菌の鞭毛は回転しているためにエネルギー供給があるにもかかわらず、動きが局所化して構造が凍結されたような特性を持ちます。 このようなアクティブガラス状態は、細胞内部のように高密度でかつ活性を保つ条件下で、どのように力学的性質が変化するかを理解する手がかりになります。すなわち、細胞内部のような密集・活性・非平衡が同時に存在する複雑な環境を、単純化されたモデル系として再現できるのです。 このように、交換チャンバーと大腸菌懸濁液を組み合わせたアクティブマター系は、代謝駆動の非平衡環境におけるマイクロレオロジー測定を可能にしました。これにより、 細胞や生体分子がどのように非平衡なダイナミクスを生み出しているのか? それが力学的性質(粘弾性や流動性)にどのように影響を及ぼすのか?
を定量的に探るための、有力な実験系となっています。
光てこを用いたマイクロレオロジー計測
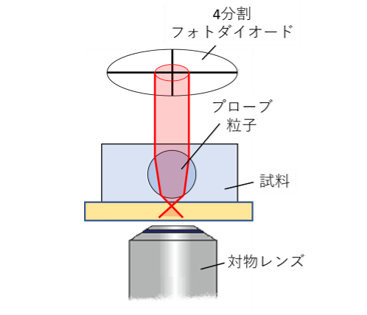
高分子ゲルなどのネットワークの力学特性をマイクロレオロジー計測する為には、ゲルの架橋点間距離よりも大きなスケールの計測粒子を用いる必要がある。しかしながらレーザー干渉法を用いたマイクロレオロジー計測の場合、レーザー波長よりも計測用粒子径が大きな幾何光学領域では、レーザーの計測感度が下がり、計測精度が低下する。そこで、光てこを用いることで、計測用コロイド粒子径の増大による計測感度低下を抑えた光学系を設計している [Figure 3, Figure 4 (原理)]。また、補償光学を組み込むことで、光学的に不均一な試料下での高い計測感度の実現化も目指している。
-
Figure 3
光てこを用いたマイクロレオロジー計測 -
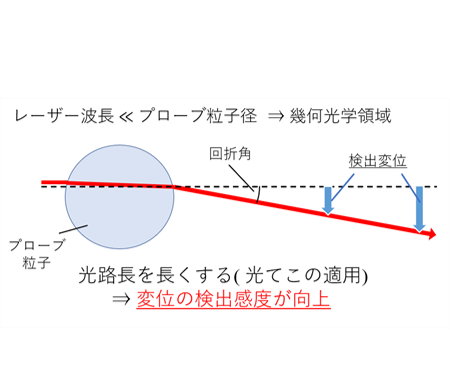
Figure 4
光てこの原理. 計測用コロイド粒子を透過したレーザー光をコロイド粒子自体で平行光にすることにより, 光路長を伸ばすと変位の検出感度が向上する.
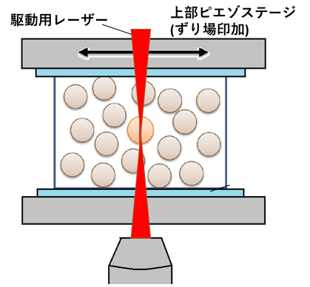
せん断応力下での濃厚コロイド懸濁液のマイクロレオロジー計測
ガラス系にマクロなずり場を印加し、マクロな応答を計測すると、その応力に対して非線形に粘性率が変化することが広く知られている。しかしながら、その詳細なメカニズムは未だに解明されていない。本研究室では、マクロなせん断応力を加えた際の、構成粒子スケールでの力学応答を計測することで、非線形ダイナミクスのメカニズムの解明を目指している (Figure 4)。また、光トラップによって、ミクロに力を印加した場合のミクロな力学応答の計測も行っており、両者での非線形ダイナミクスの比較等も行っている。